CONDUCTA REPRODUCTIVA DE LA YEGUA
La actividad reproductiva de las yeguas es estacional, con un período natural que se extiende desde la primavera hasta finales del verano. Existe una fuerte relación entre el fotoperiodo y la ovulación. Debido a su actividad ovárica y a que la gestación dura aproximadamente 11 meses, las yeguas suelen parir en la primavera, cuando las condiciones son más favorables para la supervivencia de la descendencia. En regiones tropicales, las yeguas son consideradas poliestéricas anuales, ya que la luminosidad es constante durante todo el año, permitiendo partos continuos.
Los factores nutricionales, especialmente la ingesta de energía y la condición física, son cruciales para la tasa de concepción. Es fundamental que las yeguas mantengan una buena condición durante la época de reproducción; de hecho, un ligero sobrepeso es preferible a un peso insuficiente.
En manadas, la yegua más vieja generalmente actúa como líder, mientras que los reproductores se encargan de la protección. Durante el estro, la yegua muestra signos como acercarse al macho, micción frecuente, guiños del clítoris y desviaciones de la cola, mientras que el semental exhibe comportamientos como el reflejo de Flehmen y un andar característico. En la fase diestro, la yegua se muestra tranquila, acicalándose con otras yeguas, y puede rechazar al semental si intenta montarla.

Lote de yeguas criollas colombianas , horras para evaluación reproductiva palpación e Inseminación Artificial.
ANATOMÍA
La anatomía de la yegua es importante para el trabajo reproductivo ya que el conocer todas las partes en su estado fisiológico normal nos permite diferenciar entre posibles patologías que se pudiesen presentar, por ejemplo una anormalidad sencilla como lo es el no presentarse el cierre normal de la vulva puede conllevarnos a un útero lleno de aire o una contaminación fecal.
El aparato sexual femenino está formado por los ovarios, las trompas de Falopio, los cuerpos uterinos, útero, vagina y vulva. El ovárico produce los ovulos que caen a los cuernos, donde espera a que los espermatozoides penetren a través de sus paredes para dar lugar a la conjugación de las células fecundantes. ₍₄₎
La anatomía normal proporciona tres «sellos de proteger el tracto reproductivo:
(1) El sello de la vulva – creado por la aposición de los labios vulvares
(2) El sello vestíbulo-vaginal – creado por el estrechamiento en la unión entre el vestíbulo y la vagina caudal.
(3) El cuello del útero.₍₅₎
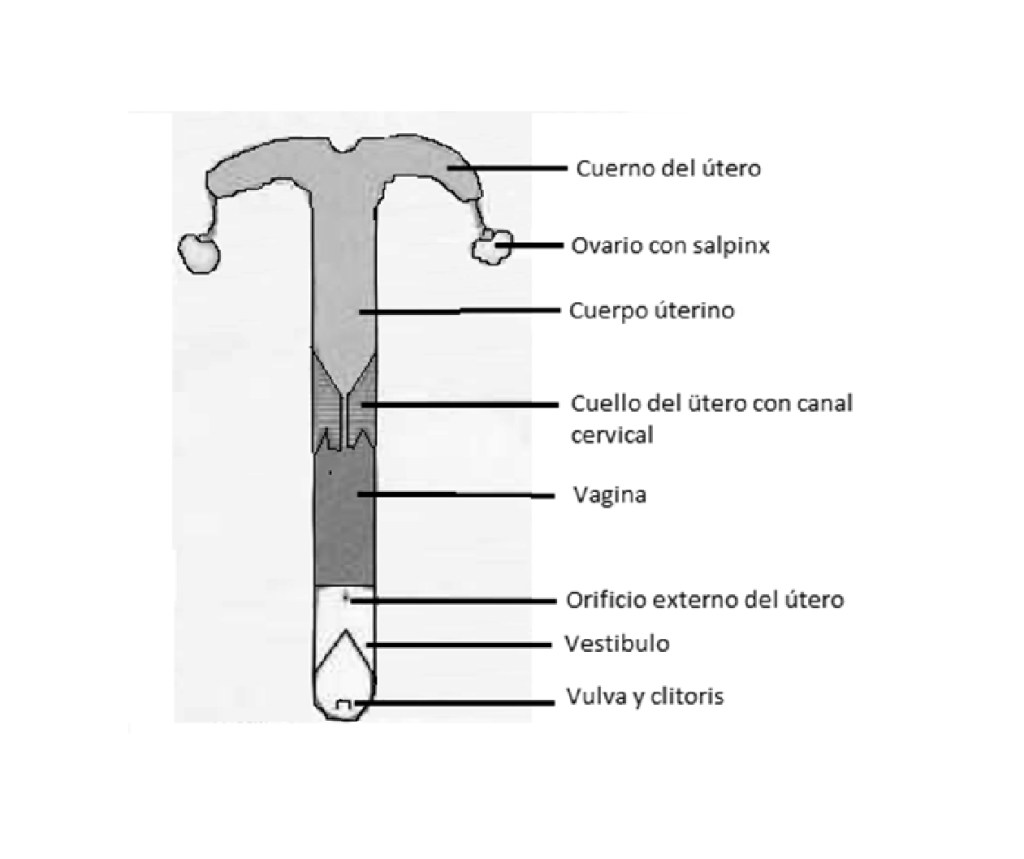
Tomado de anatomía de los animales domésticos. ₍₆₎
El clítoris se puede observar desde los labios vulvares en una posición anterior a los mismos y está compuesto de tejido eréctil. ₍₇₎ Este se observa comúnmente con el quiño vulvar cuando la yegua es receptiva al garañón.
El vestíbulo de la vulva tiene aproximadamente 12 cm de largo y la vagina entre 18 y 24 cm. La vagina de la yegua acomoda el pene del padrillo durante la penetración y es mas delgada y compacta que la vulva. En la porción anterior de la vagina se encuentra el cérvix, una estructura muscular de 12 cm aproximadamente que separa la vagina del cuerpo del útero.₍₇₎
ÚTERO
• Aproximadamente en T o en forma de Y en apariencia; que consiste en un cuerpo y dos cuernos, el promedio del cuerpo uterino son 20 cm de longitud, los cuernos se bifurcan desde el extremo craneal del cuerpo, y corren lateralmente, o dorso-lateralmente.
• Los cuernos son un promedio de 20 a 25 cm de longitud, el espesor de las paredes del útero, y el tono del miometrio, varían significativamente con el estado reproductivo y la edad. ₍₅₎
CICLO ESTRAL
Las yeguas comienzan generalmente a ponerse en celo entre los 12 y 15 meses de edad.₍₈₎
La duración promedio del ciclo estral de la yegua es de 21 días. El ciclo se divide en dos etapas, una de receptividad sexual denominada estro y que dura entre 5 y 7 días y la etapa de diestro o fase lutea, que tiene una duración promedio de 14 o 15 días. ₍₈₎ La fase estral se caracteriza por el crecimiento folicular, alta secreción de estrógenos, receptividad sexual de la yegua al semental, preparación del tracto genital para recepción y transporte de los espermatozoides y la ovulación.
La especie equina presenta afectación directa por el estimulo de horas luz es decir que el aumento de la longitud de las horas diurnas es la clave para desencadenar la liberación de cantidades adecuadas de hormona liberadora de gonadotropinas (GnRH), que es un prerrequisito para la liberación de hormona luteinizante (LH) y la ovulación.₍₁₀₎
Son muchos los folículos que se desarrollan en preparación para el estro y la ovulación. Muy cerca de esta última es que uno de los folículos crece rápidamente y se reblandece, por lo general, el crecimiento ocurre dos días antes de la ovulación y la estructura se ablanda un día antes. Los folículos son palpables en cualquier porción del ovario, pero la ovulación tiene lugar dentro de la fosa ovulatoria. ₍₁₁₎ En especies monovulares (caballos, ganado, las mujeres , el folículo dominante de una ola folicular es la resultado de un mecanismo de desviación, en el que el futuro folículo dominante continúa aumentando en diámetro y folículos subordinados comienzan a crecer a un ritmo más lento y hacen regresión. ₍₁₂₎
La mayor parte de la ovulación ocurre entre los días tres, cuatro o cinco del estro 24 a 48 horas antes del fin del mismo, el folículo roto puede palparse hasta 24 horas después de la ovulación como una zona fluctuante suave.₍₁₃₎
La fase lútea se inicia en el momento de la ovulación con la formación de un cuerpo lúteo que secreta progesterona, durante este durante esta fase del ciclo, la yegua no es receptiva al semental y el tracto genital se prepara para recibir y alimentar al embrión.
El periodo del diestro finaliza con la regresión del cuerpo lúteo y el inicio de la siguiente fase folicular. Puede ser acortado por endometritis o administración Prostaglandinas F2a (después de los cinco días).
La fase lútea largo se produce cuando el cuerpo lúteo no se lisa de forma espontánea, y puede persistir por hasta tres meses ( el diestro prolongado ).₍₅₎
La secreción tanto de hormona foliculoestimulante (FSH) como de hormona luteinizante (LH) es dirigida especialmente por picos de hormona liberadora de las gonadotropinas. Durante el ciclo estral de la yegua, las concentraciones de FSH ascienden al doble. El primer incremento tiene lugar desde el día 8 al día 14 del ciclo, y el segundo desde el día 15 hasta el día 2 del ciclo siguiente.₍₁₄₎
Después de la ovulación cuando las concentraciones de progesterona aumentan el cérvix esta firme, pálido y elevado del piso de la vagina. La abertura del cérvix se encuentra firmemente cerrada. A la palpación rectal el cérvix de una yegua en diestro es firme, redondo y fácilmente penetrable. Las secreciones uterinas, cervicales y vaginales son escasas y pastosas cuando la yegua está bajo la influencia de progesterona. El útero se vuelve redondeado, tubular y firme durante el diestro tardío o preñez temprana. Estos cambios en el tono uterino y cervical son indicadores de preñez.₍₇₎

Fuente: Medicina y Cirugía Equina₍₁₅₎
Debido a que reproductivamente la yegua de Paso Fino Colombiano se comporta de manera diferente a las demás razas, es de vital importancia entender que los parámetros reproductivos como: crecimiento folicular y tamaño folicular a la ovulación, no son los únicos a tener en cuenta, también es pertinente revisar otras evidencias como el edema uterino, la consistencia del folículo, el estado del cérvix y la disposición de la yegua al caballo.
En un estudio realizado en la sabana de Bogotá se determinó que el tamaño promedio al momento de la ovulación del folículo preovulatorio es de 41,34 +/- 2,14 mm para la raza de Paso Fino Colombiano.₍₁₆₎
CELO DEL POTRO
Las yeguas entran en celo de 9 a 11 días después de la parición aunque este periodo puede fluctuar de acuerdo con variaciones individuales, entre 3 y 13 días. Siempre que el nacimiento haya sido normal y que no existan evidencias de infección.₍₈₎
Este celo presenta todavía un útero que no a hecho involución adecuada por ello no es recomendable el servicio.
PERIODO DE GESTACIÓN
El periodo promedio de gestación es de 336 días, o un poco más de once meses, pero suele variar individualmente entre 310 y 370 días. ₍₈₎
INSEMINACIÓN ARTIFICIAL
La inseminación artificial ha sido utilizado con éxito en el caballo desde 1322, cuando el semen de un semental árabe se recuperó de la vagina de una yegua recientemente apareada, fue transportada en leche de camella y depositado en la vagina de otra yegua para producir un potro.₍₁₇₎
El interés del uso de la IA se ha incrementado en los últimos años debido al riesgo de la transmisión de enfermedades venéreas por medio de la monta natural y a los riesgos que esto implica en padrillos y/o yeguas de alto valor económico, además permite utilizar más eficientemente padrillos viejos o con trastornos musculo esqueléticos, cubrir mayor cantidad de yeguas con una mínima cantidad de saltos y reducir los costos operativos.₍₁₃₎
El semen del caballo se recolecta mediante un condón o vagina artificial. La vagina artificial costa básicamente de un cilindro rígido y poco pesado, con un forro interno de goma. Para llenar el espacio entre el forro y la estructura rígida se utiliza agua a 42- 43 grados centígrados cuya presión se mantiene mediante una válvula.₍₁₈₎
Debe evitarse que el garañón monte a la yegua hasta que no tenga una erección completa. Una vez montado, se desvía el penen hacia un lado de la yegua y hacia la vagina artificial. Esta se mantiene en su lugar hasta que el garañón desmonte y se retire el agua del aparato, de manera que todo el semen es recibido en la botella de recolección.₍₁₀₎
Actualmente se recomienda inseminar a las yeguas con 500 millones de espermatozoides con motilidad progresiva (EMP), inmediatamente pos colección, o con un billón de EMP con semen refrigerado y almacenado durante 24 horas a 5ºC. La dosis utilizada con semen criopreservado varía entre 400 a 800 millones de espermatozoides. Cuando se tiene poco número de espermatozoides para inseminar, es recomendable utilizar inseminación intrauterina.₍₁₉₎
El diluyente de leche desnatada se prepara calentando la leche desnatada dos veces durante cuatro minutos a 95 grados centígrados. Ya fría se le adicionan 1000 unidades de penicilina, 1mg de dihidroestreptomicina y 200 unidades de sulfato de polomixina B por ml de diluyente.₍₁₈₎
El diluyente de rema gelatina se prepara calentando mitad crema dos veces durante 2 -4 minutos a 95 grados centígrados. Se elimina la espuma formada y a la crema caliente se le añaden 1.3 g de gelatina Knox esterilizada en autoclave con 10 ml de agua destilada hasta completar 100 ml. Cuando se enfría se mezcla se le añade antibióticos, como se indicó para la leche desnatada. Los diluyentes pueden ser congelados y conservados hasta que se necesiten y antes de emplearlos se calienta a 38.7 -40 grados c. El semen se diluye en la proporción 1:1 o 1:4, después de recogido y eliminada su fracción ge. El gel se elimina para que el semen pueda ser diluido uniformemente y aplicado con una jeringa. El gel puede retirarse absorbiéndolo con una jeringa y haciéndole atravesar 4 -5 capas de gasa estéril.₍₁₈₎
Los espermatozoides equinos se caracterizan por mantener viables durante un periodo relativamente largo dentro del aparato genital de la hembra, no obstante existe mayor probabilidad de concepción parece lograrse cuando la monta natural o la inseminación con semen fresco se realiza entre 24 a 48 horas antes de la ovulación. En caso de IA con semen congelado, se obtienen mejores resultados inseminando dentro de las 12 horas previas a la ovulación₍₉₎
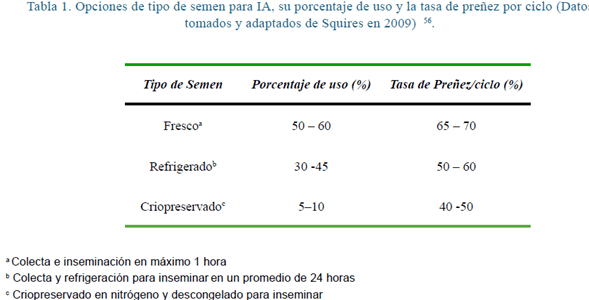
Tomado de Reproducción asistida equinos: aporte desde la teoría ₍₁₉₎
En yeguas, un número de métodos diseñados para depositar los espermatozoides más cerca el sitio de la fertilización ha evolucionado en los últimos años , que incluyen inseminación uterina profunda , la inseminación histeroscópica, intratubárica, y la inseminación intrafolicular.₍₁₇₎
Inseminación uterina profunda Buchanan y compañeros de trabajo desarrollaron una inseminación uterina profunda técnica para depositar bajo número de espermatozoides más cerca de la unión útero-tubárica. Este método implica la inseminación guiada con una pipetear a través de la luz uterina con la manipulación de la pipeta por el recto hasta que su punta se visualiza mediante ecografía o palpar en la parte craneal de la cuerno uterino.₍₁₇₎
TRANSFERENCIA DE EMBRIONES
La transferencia de embriones es una técnica de gestión que a sido muy valiosa como método de obtención de potrillos de yeguas con endometritis crónica persistente, con muerte embrionaria temprana o aborto, endometritis inducida por apareamiento – persistente. Estas condiciones generalmente se complican por laceración cervical y endometritis bacteriana o mitótica. ₍₂₀₎
El trasplante de embriones se efectúa mediante un método similar a la inseminación. El catéter es más largo y lleva una pajilla o un recipiente de poca capacidad, donde se encuentra el embrión. Este último se deposita en el cuerno ipsilaeral al ovario activo.₍₁₁₎
Los embriones equinos son transferibles, pero las tasas de éxito caen marcadamente después del Día 8 , en parte debido a la vulnerabilidad de los embriones más grandes a los daños mecánicos.₍₂₁₎
El procedimiento se lleva a cabo con un medio de cultivo adecuado que incluye proteínas y antibióticos para asegurar un alto porcentaje de supervivencia de los embriones y para eliminar la posible contaminación bacteriana. Los embriones son evaluados para comprobar su morfología e idoneidad antes de ser transferidos. Al igual que en otras especies, el éxito de la transferencia embrionaria depende enormemente del manejo de la receptora. Los mayores porcentajes de gestación se obtienen cuando la receptora ovula el día antes o hasta 3 días después que la donante.₍₁₄₎
El procedimiento se lleva a cabo con un medio de cultivo adecuado que incluye proteínas y antibióticos para asegurar un alto porcentaje de supervivencia de los embriones y para eliminar la posible contaminación bacteriana. Los embriones son evaluados para comprobar su morfología e idoneidad antes de ser transferidos. Al igual que en otras especies, el éxito de la transferencia embrionaria depende enormemente del manejo de la receptora. Los mayores porcentajes de gestación se obtienen cuando la receptora ovula el día antes o hasta 3 días después que la donante.₍₁₄₎
Infecciones uterinas en equinos infligen grandes pérdidas en la industria equina. La inflamación persistente del oviducto y el útero conduce a pérdida del embrión y yeguas susceptibles a la infección han debilitado las defensas uterinas en parte debido a la retención de enfermedades inflamatorias y exudado.₍₂₂₎
En el proceso de lavado, la infusión y recuperación de líquido en el útero debe realizarse por gravedad; generalmente se utiliza 1 L. de solución salina fosfatada buffer o ringer lactato (Hartman) por lavado, para un total de tres a cinco lavados continuos. El líquido del lavado es conducido a través de un filtro para embriones y luego el contenido del filtro es examinado en estereoscopio para localizar el embrión.
El embrión es lavado y transferido al útero de la hembra receptora. El embrión es cargado en una pajilla de inseminación (0,25 o 0,5 ml) y luego en una pistola para transferencia de embriones.₍₁₉₎
SINCRONIZACIÓN DEL ESTRO
La PGF2a la cual es una sustancia natural, provoca contracción de los músculos lisos y regresión del CL. Este producto ocasiona, a veces, considerable sudoración y algunas molestias a las yeguas.₍₁₁₎
La prostaglandina se aplica después del día 5 a 7 ya que la el cuerpo lúteo no es sensible a la prostaglandina sino hasta estos días que es cuando ya tiene una buena formación.
La inyección de PGF2A o algún análogo, provoca el estro en 3 a 6 días.₍₁₁₎
INDUCCIÓN DE LA OVULACIÓN
La programación de la ovulación se puede lograr mediante una hormona efecto luteinizante como la gonadotropina coriónica humana; la dosis es de 1500 a 3300 IM. Esta hormona se aplica únicamente cuando existe un folículo mayor a 35-40mm de diámetro. La ovulación ocurre entre las 24 a 48 horas después de la aplicación.₍₉₎
BIBLIOGRAFÍA
- Ptaszynska, M. (2007). Reproducción Equina. En M. Ptaszynska, Compendio de Reproducción Animal (págs. 129,167). Sinervia Uruguay/Paraguay: intervet.
- Vázquez Dueñas, S., Escobar Medina, F., Colina-Flores, F., & Hayden Valles, S. (2004). Comportamiento reproductivo de yeguas Pura Sangre Inglés en un criadero con partos al principio del año. Rev Biomed, 27-31.
- Nelson Alfonso Pardo Rincón, E. D. (2007). Manual de nutrición animal. Grupo Latino.
- Beltrán, J. M. (1954). GANADO CABALLAR. Barcelona: SALVAT EDITORES, S.A.
- W., G. C. (2005). Fertility and Obstetrics in the Horse. England: Blackwell Publishing Ltd.
- Horst Erich konig, V. H.-G. (s.f.). Anatomía de los animales domésticos . Tomo 2. Panamericana.
- Squires, E., & H, M. (2011). Manejo hormonal en la yegua. Segundo Congreso Argentino de Reproducción Equina, (págs. 507-513). Mendoza.
- ENSMINGER, M. (1973). PRODUCCION EQUINA. Argentina: «El ateneo»,Pedro Garcia S.A.
- Carlos Galina, J. V. (2012). Reproducción de Animales Domésticos. Galina : LIMUSA.
- Reuben J.Rose, D. R. (1993). Manual Clínico de Equinos. Interoamericana S.A.
- A.M. Sorensen, J. (1982). Reproducción Animal principios y practicas. Mexico: McGRAW-HILL.
- O.J., G., E.L, G., B.L, R., & M.O, G. (2008). Follicle diameters and hormone concentrations in the development of single versus double ovulations in mares. Theriogenology, 583–590.
- Ramirez, F. D. (s.f.). El manual del caballo. Grupo latino.
- Intervet. (2007). Compendium de reproducción animal. Sinervia .
- Colahan, P. T., Mayhew, I. G., Merrit, A. M., & Moore, J. M. (1998). Medicina y Cirugía Equina. Inter- medica.
- Ramírez, G., Gutiérrez , C., & Ramos, M. (2010). Dinámica folicular en yeguas paso fino colombiano. Revista de Medicina Veterinaria, 21-35.
- Lee Morris. (2006). Advanced Insemination Techniques. Vet Clin Equine, 693–703.
- Alarcon, F. M. (1997). El caballo. San juan de pasto : Marmor.
- Ángel, D., & Bran, J. A. (2010). Reproducción asistida en equinos: aportes desde la teoría. Rev Ces Med Vet Zootec, 56-69.
- Hurtgen, J. P. (2006). Pathogenesis and treatment of endometritis in the mare: A review. Theriogenology, 560–566.
- Betteridge, K. (2007). Equine embryology: An inventory of unanswered questions. Theriogenology, S9–S21.
- Causey, R. C. (2006). Making sense of equine uterine infections: The many faces of physical clearance. The Veterinary Journal, 405–421.

Deja un comentario