Resumen
La encefalitis protozooaria equina (EPM) es una enfermedad neurológica grave del caballo, los casos de mieloencefalitis equina protozooaria (EPM) se han reportado entre caballos nativos de Norte, Centro y Sur América, el parásito mas común asociado es el Sarcocystis neurona, la zarigüeya funciona como primer factor de propagación debido a que esporocistos del parásito se desarrolla en las heces, es una enfermedad progresiva debilitante que afecta el sistema nervioso central, los signos clínicos pueden variar de ataxia leve a parálisis, decúbito y muerte.
Introducción
EPM es la enfermedad protozoaria más importante de los caballos (2) animales con signos neurológicos de enfermedad es un candidato a tener EPM(16). Líneas de evidencia sugieren que la inmunosupresión es clave para permitir que infecciones subclínicas por S. neurona pasen clínicas (3) .
Los caballos se infectan con S. neurona, aunque unos pocos casos tienen atribuido la infección por Neospora spp.(9) por la ingestión de esporocistos contaminado alimentos y fuentes de agua. (1) . Las zarigüeyas (Didelphis virginiana, Didelphis albiventris) son sus hospedadores definitivos. Los caballos se consideran sus huéspedes aberrantes porque sólo se pueden encontrar esquizontes y merozoitos (no sarcocistos) (16). Poco se sabe de la migración y el desarrollo de S. neurona en los tejidos de los caballos. Los esquizontes y merozoitos sólo se han encontrado en el cerebro y la médula espinal. Sin embargo, una amplia búsqueda de S. neurona en tejidos extra-neuronales de los caballos no se ha hecho(18) se atribuye que . S. neurona puede cruzar la barrera de sangre del cerebro oculto dentro de los leucocitos una vez dentro de la CNS estos merozoitos pueden ingresar e invadir otras células.(11) dentro del manejo clínico esta el diagnostico por examen del líquido cefalorraquídeo (LCR) con evaluación de anticuerpos(14) aunque si los caballos tienen anticuerpos en la sangre, y se contamina la muestra de LCR con sangre periférica durante la proceso de recogida puede llevar a resultados falsos positivos.(17)
Ciclo de vida
El área de distribución natural de la zarigüeya corresponde con las áreas donde EPM es comúnmente identificado, se ha reconocido en los caballos de otros continentes, pero a la fecha, sólo en los caballos que se originaron a partir de América del Norte, América Central, y América del Sur.(4)
El parásito es heteroxeno, que requiere dos hospedadores para completar su ciclo de vida. Estudios recientes han demostrado que el gato doméstico (Felis domesticus) , la mofeta rayada (Mephitis Mephitis) , el armadillo de nueve bandas (Dasypus novemcinctus) , y el mapache (Procyon lotor) puede servir como huéspedes intermediarios de S. neurona(10). El único huésped conocido definitivo de S. neurona es la zarigüeya (Didelphis sp.) (19). Las zarigüeyas no se enferman gravemente, pero libera su fase infecciosa del parásito en las heces (5) Los caballos se infectan con S. neurona por la ingestión de esporocistos contaminado en alimentos y fuentes de agua (1) . Una vez dentro del tracto GI, los esporocistos desenquistan y liberan ocho esporozoitos que penetran en la pared intestinal y entran a células endoteliales en varios órganos. Los Merontes se desarrollan con las células huésped, que luego se rompen y liberan merozoitos en el torrente sanguíneo una vez que el huésped intermediario muere, la carne es consumida por el huésped definitivo final, completando el ciclo de vida (7).El parásito se replica en el caballo, los tipos de células huésped que están infectadas no se conoce con exactitud a excepción de los esquizontes y merozoitos que se encuentran en las neuronas, células gigantes, neutrófilos y en macrófagos, no se replican en las heces de este, por lo tanto, no se considera contagiosa a otros caballos(5)(16) Fig 1.
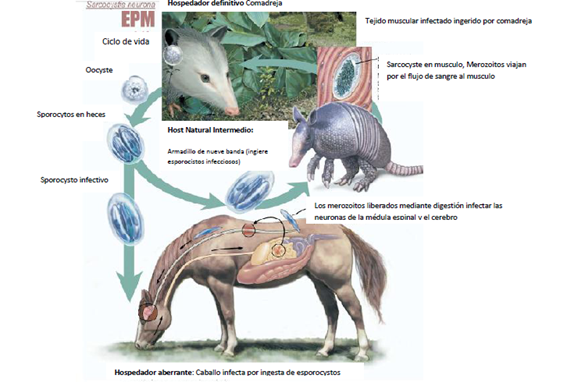
Figura 1 El ciclo de vida de Sarcocystis neurona demostrando infección aberrante en el caballo.
Tomado y modificado de Martin Furr, DVM, Dip ACVIM, PhD, 2006, Immunity, Pathophysiology, and Diagnosis of Equine Protozoal Myeloencephalitis, Clin Tech Equine Pract 5:3-8.
Signos Clínicos
Los signos se pueden desarr
ollar en algunos caballos cuando los parásitos atraviesan en la médula espinal y / o el cerebro causando lesiones perjudiciales. Otros caballos aparentemente desarrollan una respuesta inmune, librándose del organismo sin mostrar evidencia clínica de la infección.(5)
Los signos neurológicos en caballos con EPM dependen de la ubicación y la gravedad de las lesiones en la SNC. (6) pueden incluir signos de los pares craneales, tronco encefálico y cerebral(17) alteraciones de vías respiratorias superiores, cojera inusual o atípica e incluso convulsiones. En casos severos, el caballo puede tener dificultad al estar de pie, caminar, o tragar, y la enfermedad puede progresar muy rápidamente. En algunos caballos, la enfermedad parece estabilizar o permanecer estático para un período de tiempo (16) Todos los animales inoculados por vía oral con esporocistos producen anticuerpos frente a S. neurona o sarcocistos formados.
Aunque el pony no desarrolla signos clínicos neurológicos, hay un desarrollar anticuerpos contra S. neurona en suero y líquido cefalorraquídeo, lo que indica infección.(8)
Lesiones
S. neurona puede multiplicarse en el SNC de los équidos durante muchos meses. Tanto neuralmente, células inflamatorias en el SNC pueden ser parasitadas (16) en un estudio demostraron que leucocitos de caballo cultivadas con merozoitos S. neurona fueron infecciosas para los caballos inmunocompetentes. Caballos inoculados con estas preparaciones desarrollaron EPM. Postulan que los merozoitos fueron introduciendo los leucocitos y que estos leucocitos infectados fueron migrando a través de la menengies y entran en el SNC. (11)
Invade los tejidos nerviosos del caballo causando un daño progresivo y la hinchazón a la médula espinal (mielitis) y / o cerebro (encefalitis).(5) Es posible que una vez transportado al sistema nervioso central dentro de leucocitos, los merozoitos puede salir el transporte células e infectar otras células en el centro del sistema nervioso.(11)
Aunque el tronco cerebral está implicado con mayor frecuencia que otras áreas del cerebro, los Las lesiones son más frecuentes en la médula espinal. En casos raros, las lesiones pueden estar presentes tanto en el cerebro y la médula espinal del caballo.(16)
El parásito es responsable por lesiones difusas o multifocales, inflamatorias no supurativas, y lesiones del cerebro y la médula espinal(15)El mecanismo por el cual el parásito entra en el SNC es desconocida, sin embargo, una hipótesis atractiva es que el organismo infecta a los linfocitos, los cuales llevan el organismo para el SNC (17)
Manguitos perivasculares de células mononucleares es evidente en algunos de los zonas afectadas, sobre todo en las meninges. La respuesta inflamatoria es altamente variable y puede constar de infiltrados de una mezcla de linfocitos, neutrófilos, eosinófilos, células gigantes multinucleadas y células gitter(16)
Diagnostico
Un diagnóstico clínico de EPM debe considerarse tentativo en el caballo vivo, la interpretación de laboratorio, diagnóstico clínico y las pruebas auxiliares son clave para avanzar hacia un diagnóstico definitivo(17)
Un diagnóstico presuntivo de EPM puede hacerse en algunos caballos si muestran signos neurológicos que probablemente no sean causado por otras enfermedades, descartar otras causas de ataxia espinal, como malformaciones cervicales, fractura vertebral, osteoartritis cervical y herpes virus, mielitis que pueden estar presentes, la evaluación de signos o síntomas clínicos es el método de diagnóstico más común reportado(4)(17) Algunos de los métodos utilizados para identificar la exposición definitivamente a S. neurona incluyen la detección específica de anticuerpos (usando la inmunotransferencia o ensayos directos aglutinación)detección de ADN de
los organismos (Reacción en cadena de la polimerasa utilizando ensayo), o identificación de los organismos en los tejidos (4)
La detección de la infección por S. neurona por la demostración de reactividad de suero y muestras LCR con antígenos SN11, SN14 y SN16 ha sido ampliamente utilizado como una herramienta de diagnóstico, la inmunotransferencia de banda sugieren fuertemente que los anticuerpos específicos para SN14 y SN16 (13)
La prueba de Western blot en el LCR es considera para confirmar un diagnóstico de EPM en caballos que muestran signos clínicos compatibles, esta prueba detecta la presencia de S. neurona específicos de anticuerpos para SN14 y SN16 que se localizan en la superficie del parasito y tienen actividad protectora contra S. neurona, al menos in vitro. Se usa un medio líquido, que puede ser suero o LCR pero la interpretación de los resultados positivos en caballos neurológicamente normales sigue siendo incierto. Las pruebas de diagnóstico utilizando el suero y LCR Prueba WB ha demostrado tener una sensibilidad y especificidad en casos de alrededor del 89%, (5)(7)(13)
El diagnóstico está mejor apoyado por el hallazgo definitivo de anormalidades SNC en el examen neurológico, el eliminación de otras enfermedades neurológicas de pruebas auxiliares, y el hallazgo de S. neurona anticuerpos específicos en forma apropiada recogido por WB o IFAT.(17)
Tratamiento
Tratamiento de la mieloencefalitis protozooaria equina (EPM) se introdujo en 1974 sobre la base de protocolos utilizados para el tratamiento de la encefalitis toxoplásmica de los seres humanos. El régimen inicial de una sulfonamida (a veces con trimetoprim) más pirimetamina ha continuado, con alteraciones menores, hasta nuestros días (3)
Tratamiento de EPM es bastante caro, y los caballos leve o gravemente afectados a menudo requieren un tratamiento prolongado (4)Dos fármacos anti-protozoarios se han utilizado con éxito pirimetamina (Daraprim) en combinación con una sulfonamida antimicrobiana (Tales como sulfadiazina) con o sin trimetoprim, dado para un período de al menos tres meses(5)(4)(8) pirimetamina (1 mg / kg, por vía oral, una vez al día durante al menos 30 días) y trimetoprim-sulfa (30.5 mg kg /, por vía oral, dos veces al día durante al menos 30 días(6).
El diclazuril es un coccidiostático, utilizado como tratamiento alternativo para los caballos que no han respondido a la terapia tradicional o en los caballos que han desarrollado complicaciones(16) recientemente ha demostrado ser muy activo frente a tanto S. neurona y S. falcatula in vitro (14) En un estudio el ponazuril inhibió la producción de merozoitos en más que 90% en cultivos de S. neurona tratada con 1.0mg/ml ponazuril y mayor que 95% de inhibición de merozoito producción se observó cuando los cultivos infectados fueron tratados con 5.0mg/ml ponazuril. Un medicamento adicional para EPM es nitazoxanida, el cual tiene una actividad de amplio espectro contra bacterias, protozoos y helmintos tiene actividad in vitro contra S. neurona (2)(16).
Tratamientos suplementarios o auxiliares, tales como estimulantes inmunes se han sugerido para asistencia posible en el tratamiento de caballos con EPM.(16)
Conclusiones
Es una enfermedad de alta prevalencia que se puede confundir fácilmente con cualquier otra enfermedad de presentación nerviosa debido a los signos clínicos tan inespecíficos, el control de la presencia de hospedadores definitivos como la zarigüeya puede ayudar a mitigar la presencia de la enfermedad.
La presentación de signos clínicos y de lesiones se hacen evidentes cuando el animal ya se encuentra en un estado de parasitemia avanzado, debido a que la enfermedad es progresiva y debilitante aunque hay factores como la presencia de inmunosupresión que pueden desencadenar o no una fase clínica en el paciente
Las dificultades diagnosticas son evidentes ya que la prueba más cotidiana de Wester blot detecta la presencia del antígeno, estando en su fase patógena y/o exposiciones antiguas de este que se evidencian en sangre, pudiendo dar falsos positivos. El manejo en campo seria el descarte de otras afecciones neurológicas, con pruebas especificas como lo son radiografías de segmentos cervicales, o mielografias además de un examen semiologíco del SNC.
Bibliografía
1. Jessica S. Hoane,1 Jennifer K. Morrow,2 William J. Saville,3 J. P. Dubey,4David E. Granstrom,4 and Daniel K. Howe1,2005, Enzyme-Linked Immunosorbent Assays for Detection of Equine Antibodies Specific to Sarcocystis neurona Surface Antigens, CLIN. DIAGN. LAB. IMMUNOL 12, 1050–1056.
2. David S. Lindsay a;_, J.P. Dubey b, Thomas J. Kennedy c, 2000, Determination of the activity of ponazuril against Sarcocystis neurona in cell cultures, Veterinary Parasitology, 92 , 165–169.
3. Robert J. MacKay, 2006, Equine Protozoal Myeloencephalitis: Treatment, Prognosis, and Prevention, Clin Tech Equine Pract 5,9-16.
4. E.G. CLARK, H.G.G. TOWNSEND AND N.T. McKENZIE, 1981Equine Protozoal Myeloencephalitis: A Report of Two Cases From Western Canada, Can. vet. J. 22, 140-144 .
5. Dr. W. David Wilson and Laurie Fio, 1996, EQUINE PROTOZOAL MYELITIS – A DISEASE IN THE NEWS, JOURNAL OF EQUINE VETERINARY SCIENCE,16, 362-365.
6. W. Kent Scarratt] Virginia A. Buechner-Maxwell] Stacey Karzenski, 1 Mark A. Wallace] John L. Robertson 2, 1999, URINARY INCONTINENCE AND INCOORDINATION IN THREE HORSES ASSOCIATED WITH EQUINE PROTOZOALMYELOENCEPHALITIS, 19,642-645.
7. Martin Furr, 2006, Immunity, Pathophysiology, and Diagnosis of Equine Protozoal Myeloencephalitis, Clin Tech Equine Pract 5, 3-8.
8. M.A. Cheadlea,*, C.A. Yowella, D.C. Sellonb, M. Hinesb, P.E. Ginna, A.E. Marshc, J.B. Damea, E.C. Greinera,2001, International Journal for Parasitology, 31,843-849.
9. M.G. Rossanoa, H.C. Schott IIb, A.J. Murphyc, J.B. Kaneenea, D.C. Sellond, M.T. Hinesd, T. Hochstatterd, J.A. Belle, L.S. Mansfielde,2005, Parasitemia in an immunocompetent horse experimentally challenged with Sarcocystis neurona sporocysts, Veterinary Parasitology 127, 3–8.
10. H. M. Elsheikha, H. C. Schott II,and L. S. Mansfield, 2006, Genetic Variation among Isolates of Sarcocystis neurona, the Agent of Protozoal Myeloencephalitis, as Revealed by Amplified Fragment Length Polymorphism Markers, INFECT. IMMUN,74, 3448–3454.
11. David S. Lindsay a,*, Sheila M. Mitchell a, Jibing Yang b, J.P. Dubey c, Robert M. Gogal Jr.a,d, Sharon G. Witonsky b, 2006, Penetration of equine leukocytes by merozoites of Sarcocystis neurona, Veterinary Parasitology, 138, 371–376.
12. David S. Lindsay a,∗, J.P. Dubey b, 2001, Determination of the activity of pyrantel tartrate against Sarcocystis neurona in gamma-interferon gene knockout mice Veterinary Parasitology, 97, 141–144.
13. FANG TING LIANG, DAVID E. GRANSTROM, XIAO MIN ZHAO, AND JOHN F. TIMONEY, 1998, Evidence that Surface Proteins Sn14 and Sn16 of Sarcocystis neurona Merozoites Are Involved in Infection and Immunity†, INFECT. IMMUN.,66, 1834–1838.
14. A.E. Marsh a;_, A.L. Mullins a, J. Lakritz b, 2001, In vitro quantitative analysis of 3H-uracil incorporation by Sarcocytis neurona to determine efficacy of anti-protozoal agents ,Veterinary Parasitology, 95,241–249.
15. Germain Nappert, Andre Vrins, Luc Breton, Michel Beauregard, 1989, A retrospective study of nineteen ataxic horses, Can Vet J ,30, 802-806.
16. J.P. Dubey a;_, D.S. Lindsay b;1, W.J.A. Saville c, S.M. Reedd, D.E. Granstrom e, C.A. Speer f;2, 2001, A review of Sarcocystis neurona and equine protozoal myeloencephalitis (EPM), Veterinary Parasitology, 95, 89–131.
17. Martin Furr, DVM, Dip ACVIM, PhD, 2006, Immunity, Pathophysiology, and Diagnosis of Equine Protozoal Myeloencephalitis, Clin Tech Equine Pract 5:3-8.
18. J.P. Dubey, 2001, Migration and development of Sarcocystis neurona in tissues of interferon gamma knockout mice fed sporocysts from a naturally infected opossum, Veterinary Parasitology, 95, 341–351.
19. Bruce K. Wobeser, Dale L. Godson, Daniel Rejmanek, Patricia Dowling, 2009, Equine protozoal myeloencephalitis caused by Neospora hughesi in an adult horse in Saskatchewan, Can Vet J, 50, 851–853.

Deja un comentario